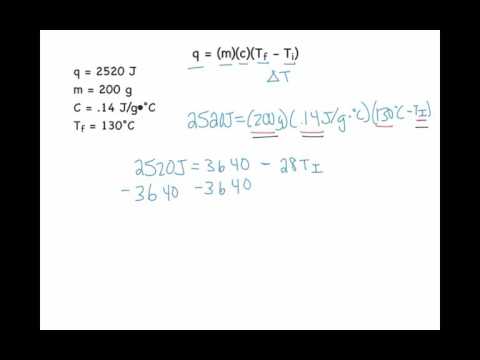
Inhoud
- Specifieke thermische capaciteit
- Thermische energie
- Energievergelijking voor thermische capaciteit
- Begintemperatuur
Temperatuur is een fysische eigenschap van materie die een maat is voor hoeveel thermische energie zich in elk molecuul van een stof bevindt. Energie kan worden toegevoegd of verwijderd uit de stof om de temperatuur te verhogen of te verlagen. Het specifieke thermisch vermogen van een stof is de verhouding van de hoeveelheid warmte die nodig is om de temperatuur van 1 gram van de stof met 1 graad te verhogen. De begintemperatuur van een stof die is verwarmd of gekoeld kan worden bepaald met behulp van deze eigenschap van materie.

Specifieke thermische capaciteit
Specifieke warmte is een fysische eigenschap van materie die wordt gedefinieerd als hoeveel een stof moet worden verwarmd of gekoeld om warmte-energie te verkrijgen of te verliezen. Het specifieke thermische vermogen van koper is bijvoorbeeld 0,385 joule per gram. Dit wordt geïnterpreteerd als te betekenen dat 0,385 joules thermische energie vereist is om de temperatuur van een enkele gram koper met 1 ° C te verhogen.
Thermische energie
De thermische energie die wordt toegepast op een stof houdt rechtstreeks verband met het specifieke thermisch vermogen van die stof. Binnen de context van thermische capaciteitsvergelijkingen is energie de hoeveelheid warmte die wordt toegepast op een stof, gemeten in eenheden die joules worden genoemd. Deze thermische energie geeft aan hoeveel een stof met een hoeveelheid massa wordt verwarmd of gekoeld, afhankelijk van het thermische vermogen en de massa van de stof.
Energievergelijking voor thermische capaciteit
De relatie tussen thermische capaciteit, energie, massa en temperatuur wordt uitgedrukt in de vergelijking E = mc (Tt), waarbij E de thermische energie is die op de stof wordt toegepast, m de massa van de stof, c de specifieke thermische energie van de stof, T is de eindtemperatuur et is de begintemperatuur van de substantie. Om de starttemperatuur te vinden, herschikt u de energievergelijking om het op te lossen voor de begintemperatuur. Dit resulteert in de vergelijking t = - ((E / (c) (m)) - T).
Begintemperatuur
Om de begintemperatuur in een specifieke warmtevergelijking te vinden, vervangt u de bekende waarden voor energie, thermische capaciteit, massa en eindtemperatuur in de vergelijking t = - ((E / (c) (m)) - T). Bijvoorbeeld, als e = 0.975 joules, c = 0.72 joules / gram * kelvin, m = 35.82 gram et = 289.41 kelvin, dan is t = - ((0.975 / (0.72 * 35.82) ) -289,41) = 327,215 Kelvin, hetgeen ongeveer 54,215 ° C is


