Inhoud

Als je al azijn (dat ethaanzuur bevat) en natriumbicarbonaat, wat een base is, hebt gemengd, dan heb je een zuur-base-neutralisatiereactie gezien. Net als bicarbonaat en azijn, zullen de twee neutraliseren wanneer zwavelzuur wordt gemengd met een base. Dit type reactie wordt chemisch neutralisatie genoemd.
Kenmerken
Chemici definiëren zuren en basen op drie verschillende manieren, maar de meest bruikbare en bekende definitie beschrijft een zuur als een stof die waterstofionen afgeeft terwijl de base ze ontvangt.sterke zuren zijn beter voor ionendonatie en zwavelzuur is beslist een sterk zuur. Wanneer het vervolgens in water wordt geplaatst, wordt het bijna volledig gedeprotoneerd - in de praktijk schonken alle zuurmoleculen hun twee waterstofionen. Gedoneerde ionen worden opgevangen door watermoleculen, die, wanneer ze worden opgeladen, hydroniummoleculen worden. De formule voor een hydroniumion is H30 +.
Reactie
Wanneer de base of alkalische oplossing wordt toegevoegd aan het zwavelzuur, reageren en neutraliseren beide. De base verwijdert waterstofionen uit de geladen watermoleculen, waardoor een hoge concentratie hydroxide-ionen vrijkomt. Deze reageren, samen met hydronium, om meer water- en zoutmoleculen te vormen (het product van een zuur-base-reactie). Omdat zwavelzuur sterk is, kunnen er twee dingen gebeuren. Als de base ook sterk is, zoals kaliumhydroxide, zal het resulterende zout (bijvoorbeeld kaliumsulfaat) neutraal zijn. Met andere woorden, noch zuur noch basisch. Aan de andere kant, als de base zwak is, zoals ammoniak, zal het resulterende zout zuur zijn, dat werkt als een zwak zuur (bijvoorbeeld ammoniumsulfaat). Het is belangrijk op te merken dat aangezien het zout twee waterstofionen heeft die kunnen worden gedoneerd, één molecuul zwavelzuur twee moleculen van een base, zoals natriumhydroxide, kan neutraliseren.
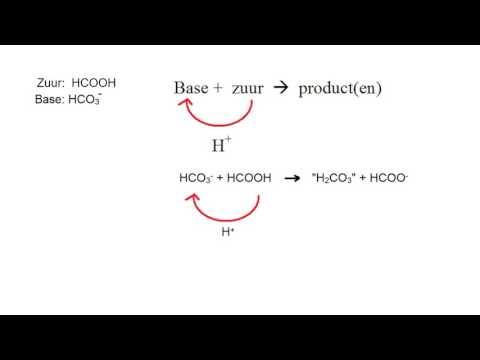
Zwavelzuur en natriumbicarbonaat
Omdat natriumbicarbonaat vaak wordt gebruikt om gemorste zuur uit cellen en batterijen of in laboratoria te neutraliseren, is de reactie van zwavelzuur met bicarbonaat een bekend voorbeeld dat een kleine tegenslag veroorzaakt. Wanneer het bicarbonaat in contact komt met de zwavelzuuroplossing, accepteert het de waterstofionen om koolzuur te worden, dat kan ontleden om water en kooldioxide vrij te geven. Als zwavelzuur en bicarbonaat reageren, hoopt de concentratie van koolzuur zich echter snel op, waardoor de vorming van kooldioxide wordt bevorderd. Een kokende massa bellen vormt zich als koolstofdioxide uit de oplossing ontsnapt. Deze reactie is een eenvoudige illustratie van het principe van Le Chatellier - wanneer veranderingen in concentraties een dynamisch evenwicht veranderen, reageert het systeem om dat evenwicht te herstellen.
Nog een voorbeeld
De reactie tussen zwavelzuur en calciumcarbonaat lijkt enigszins op de reactie met bicarbonaat - koolstofdioxide komt naar buiten in de vorm van bellen en het gegenereerde zout is calciumsulfaat. De reactie van zwavelzuur met een sterke base, zoals natriumhydroxide, produceert natriumsulfaat, terwijl zwavelzuur dat reageert met koperoxide de blauwe verbinding vormt die koper (II) sulfaat wordt genoemd. Zwavelzuur is zo sterk dat het zelfs kan worden gebruikt om een waterstofion in het salpeterzuur te plaatsen, waardoor het nitroniumion wordt gevormd. Deze reactie wordt gebruikt bij de productie van een van de beroemdste explosieven ter wereld: Trinitrotolueen of TNT.


